Ministerstwo Zdrowia ogłosiło nową, listopadową listę leków zagrożonych brakiem dostępności w Polsce. W uproszczeniu oznacza to, że tych leków brakuje już w ponad 5% aptek na terenie Polski.
Badania kliniczne preparatu MS1819
Firma biotechnologiczna AzurRx BioPharma we współpracy z europejską firmą farmaceutyczną Mayoly Spindler zarejestrowała już 6 pacjentów w badaniach klinicznych fazy IIa preparatu MS1819. Docelowo firma planuje zarejestrować 12-15 pacjentów do tej fazy badań klinicznych w Australii i Nowej Zelandii.
FDA rozszerzyła listę mutacji CFTR w terapii ivakaftorem
Amerykańska Agencja ds. Żywności i Leków zatwierdziła nowe, rozszerzone wskazania do stosowania leku zawierającego iwakaftor u osób z mukowiscydozą w wieku 2 lat i starszych, które mają jedną z pięciu mutacji: 2789+5G—>A, 3272-26A—>G, 3849+10kbC—>T, 711+3A—>G oraz E831X. To kolejna zmiana, 3 miesiące temu rozszerzono listę z 10 do 33 mutacji.
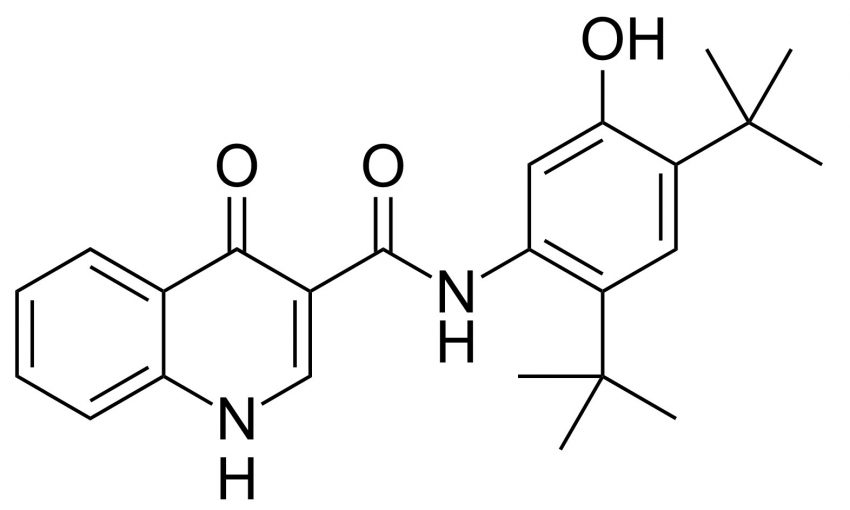
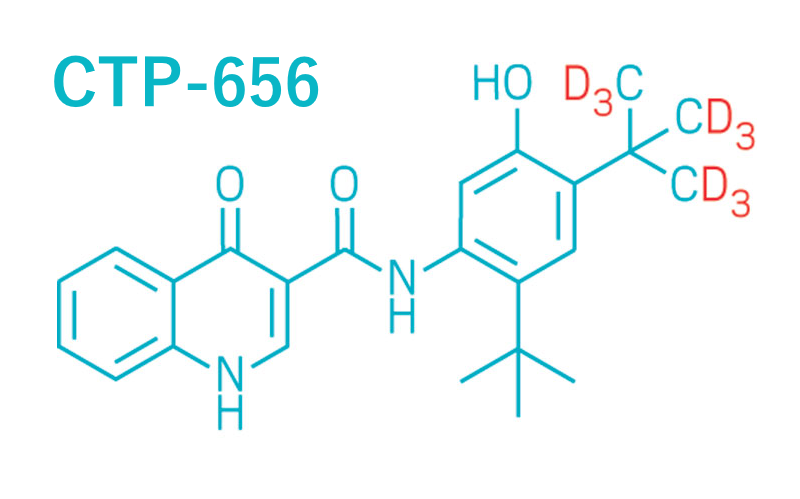
CTP-656 – deuterowany lek na mukowiscydozę za 160 milionów dolarów
Deuterowane leki to nowość na rynku farmaceutycznym. W tym roku Amerykańska Agencja ds. Żywności i Leków (FDA) pozytywnie zaopiniowała substancję aktywną o nazwie deutetrabenazyna (firmy Teva Pharmaceuticals), substancję czynną leku stosowanego w leczeniu pląsawicy związanej z chorobą Huntingtona.