Deuterowane leki to nowość na rynku farmaceutycznym. W tym roku Amerykańska Agencja ds. Żywności i Leków (FDA) pozytywnie zaopiniowała substancję aktywną o nazwie deutetrabenazyna (firmy Teva Pharmaceuticals), substancję czynną leku stosowanego w leczeniu pląsawicy związanej z chorobą Huntingtona.
Ale czym są deuterowane leki i co mają wspólnego z mukowiscydozą?
W deuterowanych lekach stosuje się ciężki izotop wodoru – deuter. Deuter został odkryty w 1931 roku przez Harolda Claytona Ureya, chemika z Columbia University, za co otrzymał on Nagrodę Nobla z chemii w 1934 roku.
Okazuje się, że wiązania atomowe między deuterem a węglem są silniejsze niż te między dwoma atomami węgla. Ten fakt sprawia, że substancje chemiczne z takimi wiązaniami są bardziej odporne na działanie enzymów w ludzkim organizmie. Udało się to potwierdzić w badaniach klinicznych przykładowo wspomnianej wyżej deutetrabenazyny.
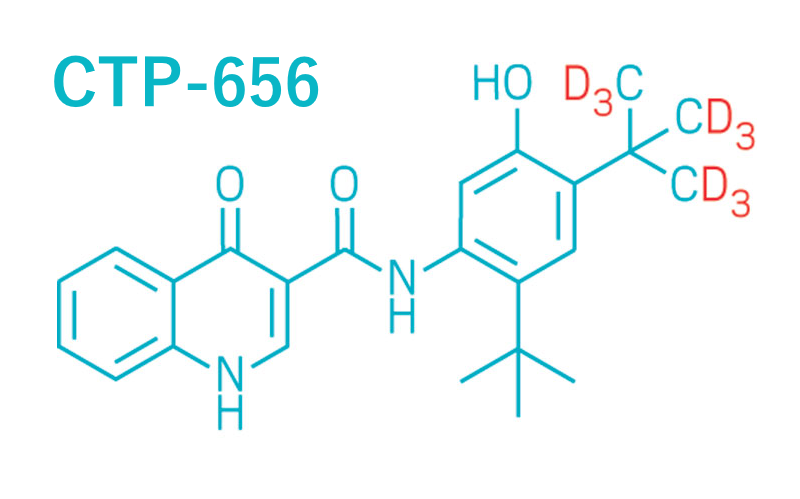
Concert Pharmaceuticals, to biotechnologiczna firma opracowująca deuterowane leki. W portfolio ma aktualnie kilka deuterowanych kandydatów na nowe leki. W tym CTP-656, deuterowany iwakaftor. Zwykły iwakaftor jest substancją czynna kilku leków firmy Vertex Pharmaceuticals, stosowanych w terapii mukowiscydozy. Od 2016 roku iwakaftor jest dopuszczony do obrotu w Polsce, w preparacie prostym oraz złożonym z lumakaftorem.
Czym się wyróżnia CTP-656? Głównie dłuższym okresem półtrwania oraz dłuższym okresem wydalania z organizmu. Ponieważ deuter jest podobny pod względem wielkości i kształtu do wodoru, biologiczna aktywność leku powinna pozostać taka sama lub podobna.
W marcu 2015 r. rozpoczęto badania kliniczne fazy I CTP-656. Badanie to przeprowadzono na 15 zdrowych ochotnikach. W badaniu potwierdzono lepsze właściwości farmakokinetyczne CTP-656 w porównaniu do preparatu z iwakaftorem, w tym zmniejszenie szybkości klirensu (współczynnik oczyszczania krwi przez nerki), wydłużenie okresu półtrwania i zwiększenie stężenia w osoczu krwi.
W listopadzie 2015 r. przeprowadzono kolejne badania kliniczne fazy I, w których potwierdzono profil bezpieczeństwa leku.
W grudniu 2016 r. rozpoczęto randomizowane badania kliniczne fazy II, w celu oceny bezpieczeństwa i skuteczności CTP-656 u pacjentów z mukowiscydozą. Wyniki spodziewane są do końca 2017 r.
W trzecim kwartale 2017 r. zaplanowane były badania kliniczne fazy II u pacjentów z mukowiscydozą w Europie.
W marcu 2017 r. Vertex nabył od Concert Pharmaceuticals prawa do CTP-656 (za 160 milionów amerykańskich dolarów). Wczoraj Vertex otrzymał zielone światło od Federalnej Komisji Handlu w USA na przejęcie aktywów Concert Phrmaceuticals. Transakcja ma być sfinalizowana w najbliższych dniach.